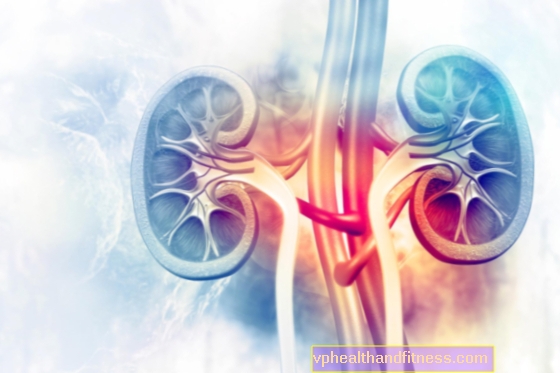
2014年4月22日火曜日-医師が冷凍庫を開けて、救命手術で使用する腎臓、肝臓、または心臓を選択できると想像してください。 以下は、これを達成するのが非常に難しい理由を説明しています。
新しい腎臓、置換心臓、または別の重要な臓器が必要な場合、多くの選択肢はありません。 これは、命を救うことができる移植のための健康な人間の臓器になると、需要と供給の間に大きな溝があるからです。
米国では、2013年に26, 517個の臓器が移植されましたが、120, 000人以上の患者が待機リストに載っています。 簡単に言えば、誰にとっても十分な寄付がありません。
さらに悪いことに、利用可能な臓器は、ドナーから取り除かれた後の貯蔵寿命があまり長くないために無駄になることがあります。
現時点でできる最善の方法は、患者を摂氏0度以上の特別なソリューションに1〜2日間保管することです。これにより、完全に適合した受信者である患者を見つけるのに時間がかかりません。
しかし、可能な答えがあります。 科学者が臓器を凍結し、損傷を与えることなく臓器を持ち帰る方法を見つけることができた場合、数週間または数ヶ月保持することができます。
同じことが、実験室で設計された臓器でも可能です。 これを念頭に置いて、カリフォルニア州のNASAリサーチパークにあるシンギュラリティ大学の研究所に付属する慈善団体であるクリックオルガン保存アライアンスは、この点で進歩を奨励する人々のために億万長者賞を創設する予定です。
それでは、移植外科医が冷凍庫を開け、腎臓、肝臓、心臓を選択して救命手術を行う時期を垣間見ることができますか?
科学者たちは、40年の間、ヒト細胞の小グループを凍結保存または凍結に成功させてきました。
細胞を破壊し、致命的な収縮から保護することができる氷晶の形成を防ぐ、いわゆる凍結保護化合物の溶液で細胞をあふれさせる胚珠と胚を保存します。
残念なことに、このプロセスをより大規模に実装しようとすると、彼らは大きな障害に直面します。最も複雑な臓器および組織内のアーキテクチャは、氷の結晶に関連する損傷に対してはるかに脆弱だからです。
ただし、一部の研究者グループは、自然の手がかりに従って、あきらめずに挑戦に備えています。
たとえば、南極のアイスフィッシュは、体液の凝固点を下げて結合する不凍タンパク質(AFP)のおかげで、摂氏-2度の非常に冷たい水で生き残ります。氷の結晶が広がりを止めます。
研究者たちは、南極のアイスフィッシュAFPを含む溶液を使用して、ゼロ以下数度で最大24時間、ラットの心臓を保護しました。
しかし、この動物のAFPでは、低温では逆効果が発生します。それらは氷結晶の形成を強制し、細胞膜を貫通する鋭いポイントを生成します。
-60°Cに耐えることができる、アラスカの甲虫で最近発見された別の不凍化合物は、より有用かもしれません。
しかし、不凍液の成分だけでは役に立たないでしょう。 これは、凍結が細胞の内外の流体の流れに影響を与えることで細胞を破壊するためです。
セル間のスペースに氷が形成され、液体の体積が減少し、溶解した塩やその他のイオンの濃度が増加します。 水は細胞から外に飛び出して補償し、しおれさせて死にます。
胚珠および胚では、グリセロールなどの凍結保護化合物が非常に有用です。細胞内での氷の形成を防ぐために水を置換するだけでなく、細胞の収縮と死を防ぐのにも役立ちます。
問題は、これらの化合物が器官の同じ魔法で機能できないことです。 一方では、組織細胞は氷の浸透によりずっと敏感です。
そして、細胞が保護されている場合でも、細胞間の空間に形成される氷の結晶は、器官を一緒に保持し、その機能を促進する細胞外構造を破壊します。
氷結の危険を克服する1つの方法は、それが起こるのを防ぐことです。 そのため、一部の科学者はガラス化と呼ばれる技術に専念しています。これにより、組織は非常に冷たくなり、氷のないガラスになります。
この方法はすでにいくつかの不妊治療クリニックで使用されており、複雑な組織の保存に関してこれまでで最も有望な結果をもたらしています。
たとえば、2000年に、サウスカロライナ州チャールストンのCell and Tissue SystemsのMike Taylorと彼の同僚は、細胞と臓器の間に位置するウサギの静脈の5cmの長さのセグメントをガラス化しました。複雑であり、加熱後もほとんどの機能を保持することが示されました。
2年後、カリフォルニア州に本拠を置く凍結保存研究会社である21世紀医学のグレッグフェイと彼の同僚は、ガラス転移温度以下に維持してウサギの腎臓をガラス化しました-摂氏122度で10分間、解凍してから48日間生きたウサギに移植してから、調べて屠殺しました。
「その後の生命維持に不可欠な臓器が凍結保存され移植されたのは初めてでした」とFahy氏は言います。 「それが現実的な提案であるという証拠でした。」
しかし、主に特定の部分である髄質が凍結防止剤溶液を吸収するのに時間がかかったため、腎臓は健康なバージョンと同じようには機能しませんでした。
「私たちは元気でしたが、改善しなければならないことも知っていました」とFahy氏は付け加えます。
「これが最も近い」とテイラーは言い、注意書きを付け加えた。 「それは10年以上前であり、この手法が十分に堅牢であれば、その発見を証明する報告書と追跡調査が存在するはずでした。
Fahyは、彼の方法の重要な部分である化学物質の生産を停止したため、一部は進歩が遅いと言います。 しかし、彼のグループは地位を取り戻し、前進しました:2013年のCryobiology Societyの年次総会で、Fahyは、凍結防止剤をコードにもっと速くロードできる方法を発表しました。
Fahyの楽観にもかかわらず、大きな臓器の保存に関しては、ガラス化が手ごわい課題をもたらすことは明らかです。 そもそも、保護するはずの細胞や組織を毒する可能性のある高濃度の凍結防止剤(従来の徐冷よりも少なくとも5倍大きい)が必要です。
化合物をロードするのにより多くの時間が必要であるため、組織が大きいと問題が悪化します。これは、冷却時間が遅くなり、有毒な曝露が発生する機会が増えることを意味します。 また、冷却が速すぎたり、温度が低すぎたりすると、亀裂が生じる場合があります。
この非常にデリケートな加熱プロセスには、より多くの障害があります。 ビトリファイド試験片が急速に加熱されないか、かなり均一に加熱されない場合、ガラス質は結晶化、失透として知られるプロセスに取って代わり、亀裂が発生する可能性があります。
(これは)ミネソタ大学の低温生物学者でありエンジニアのジョン・ビショフ氏によると、まだ克服されていない課題です。制限要因は、解凍できる速度と均一性です。温暖化は通常、外側から内側に向かって行われます。
昨年、Bischofと大学院生のMichael Etheridgeは、この問題を解決する方法を提案しました。それは、凍結防止剤溶液に磁性ナノ粒子を追加することです。
その考えは、粒子が組織全体に分散し、磁場によって励起されると、すべてを迅速かつ均一に加熱することです。 デュオは現在、テイラーと彼の同僚と協力して、ウサギの動脈でこの方法をテストしています。
ほとんどの場合、この分野の進歩は試行錯誤によってもたらされました。解決策と凍結融解の方法の組み合わせをテストすることです。
しかし、研究者は新しい技術を利用して、細胞や組織内で氷がどのように振る舞うかをより詳しく調べることも始めています。
プロセスが詳細に理解されている場合、それらを制御するための革新的でより効果的な方法を設計できることが期待できます。
過去12か月で、この分野で大きな進歩がありました。 ピッツバーグのカーネギーメロン大学の機械エンジニアであるヨード・ラビンと協力しているテイラーは、大容量の布地で高解像度のフルカラー熱画像を視覚化できる新しいデバイスを導入しました。
一方、ペンシルバニア州のビジャノバ大学のイェンス・カールソンは、最近、氷が2つのしっかりと結合した細胞の間の小さなポケットに入り、その中で結晶化を起こす瞬間から超スローモーション顕微鏡ビデオシーケンスをキャプチャしました。
これらの方法の視点は、凍結プロセスを操作する方法に新しいアイデアをもたらす可能性がある、とカールソン氏は言う。彼は、凍結融解プロセスではなく、凍結融解プロセスを慎重に制御することで組織を凍結保存する方法を見つけようとしているガラス化の。
1つの可能性は、凍結保存に抵抗することができる細胞間接合を形成するように説得できる細胞を遺伝的に設計することです。 次のタスクは、細胞外の氷の形成を指揮し、臓器の機能に影響を与えないようにする方法を見つけることです。
カールソンは、凍結プロセスのコンピューターシミュレーションを使用して、数百万の可能なプロトコルを効果的にテストすることも喜んでいます。
「進歩を加速するためにこの種のツールが必要です」とカールソン氏は語ります。カールソン氏は、タスクを「その努力に捧げる資金のほんの一部で月に到達しようとする」と比較しています。
限られた資源でさえ、この領域は、血管部分などの小さな組織に対して、氷のない凍結保存が実用的であることを示しています。 「残っている重要な障壁は、人間の臓器に合わせて拡張することです」とテイラーは言います。
ガラス化が人間の臓器に役立つ前にそのような努力が「壁にぶつかる」と疑うカールソンにとって、凍結法(または彼が氷ベースの方法と呼ぶもの)は同等またはさらには道を表す成功に向けてより信頼できる。
しかし、真剣に受け止めなければならない最後の概念があります。 「凍結保存技術は、構成細胞の100%の生存を提供しません」とテイラーは言います。
「多くの用途でこれは許容されますが、単一の臓器では、保管または移植後に修復するためにかなりの程度の損傷を意味する可能性があります。」
最終的に、それは、標本がどれほど低温保存されていても、新しく取得された器官と比較して質が劣る可能性が高いことを意味します。
出典:
タグ:
再生 用語集 ウェルネス
新しい腎臓、置換心臓、または別の重要な臓器が必要な場合、多くの選択肢はありません。 これは、命を救うことができる移植のための健康な人間の臓器になると、需要と供給の間に大きな溝があるからです。
米国では、2013年に26, 517個の臓器が移植されましたが、120, 000人以上の患者が待機リストに載っています。 簡単に言えば、誰にとっても十分な寄付がありません。
さらに悪いことに、利用可能な臓器は、ドナーから取り除かれた後の貯蔵寿命があまり長くないために無駄になることがあります。
現時点でできる最善の方法は、患者を摂氏0度以上の特別なソリューションに1〜2日間保管することです。これにより、完全に適合した受信者である患者を見つけるのに時間がかかりません。
しかし、可能な答えがあります。 科学者が臓器を凍結し、損傷を与えることなく臓器を持ち帰る方法を見つけることができた場合、数週間または数ヶ月保持することができます。
同じことが、実験室で設計された臓器でも可能です。 これを念頭に置いて、カリフォルニア州のNASAリサーチパークにあるシンギュラリティ大学の研究所に付属する慈善団体であるクリックオルガン保存アライアンスは、この点で進歩を奨励する人々のために億万長者賞を創設する予定です。
凍結保存することは可能ですか?
それでは、移植外科医が冷凍庫を開け、腎臓、肝臓、心臓を選択して救命手術を行う時期を垣間見ることができますか?
科学者たちは、40年の間、ヒト細胞の小グループを凍結保存または凍結に成功させてきました。
細胞を破壊し、致命的な収縮から保護することができる氷晶の形成を防ぐ、いわゆる凍結保護化合物の溶液で細胞をあふれさせる胚珠と胚を保存します。
残念なことに、このプロセスをより大規模に実装しようとすると、彼らは大きな障害に直面します。最も複雑な臓器および組織内のアーキテクチャは、氷の結晶に関連する損傷に対してはるかに脆弱だからです。
ただし、一部の研究者グループは、自然の手がかりに従って、あきらめずに挑戦に備えています。
たとえば、南極のアイスフィッシュは、体液の凝固点を下げて結合する不凍タンパク質(AFP)のおかげで、摂氏-2度の非常に冷たい水で生き残ります。氷の結晶が広がりを止めます。
研究者たちは、南極のアイスフィッシュAFPを含む溶液を使用して、ゼロ以下数度で最大24時間、ラットの心臓を保護しました。
しかし、この動物のAFPでは、低温では逆効果が発生します。それらは氷結晶の形成を強制し、細胞膜を貫通する鋭いポイントを生成します。
-60°Cに耐えることができる、アラスカの甲虫で最近発見された別の不凍化合物は、より有用かもしれません。
しかし、不凍液の成分だけでは役に立たないでしょう。 これは、凍結が細胞の内外の流体の流れに影響を与えることで細胞を破壊するためです。
セル間のスペースに氷が形成され、液体の体積が減少し、溶解した塩やその他のイオンの濃度が増加します。 水は細胞から外に飛び出して補償し、しおれさせて死にます。
胚珠および胚では、グリセロールなどの凍結保護化合物が非常に有用です。細胞内での氷の形成を防ぐために水を置換するだけでなく、細胞の収縮と死を防ぐのにも役立ちます。
問題は、これらの化合物が器官の同じ魔法で機能できないことです。 一方では、組織細胞は氷の浸透によりずっと敏感です。
そして、細胞が保護されている場合でも、細胞間の空間に形成される氷の結晶は、器官を一緒に保持し、その機能を促進する細胞外構造を破壊します。
ガラス化
氷結の危険を克服する1つの方法は、それが起こるのを防ぐことです。 そのため、一部の科学者はガラス化と呼ばれる技術に専念しています。これにより、組織は非常に冷たくなり、氷のないガラスになります。
この方法はすでにいくつかの不妊治療クリニックで使用されており、複雑な組織の保存に関してこれまでで最も有望な結果をもたらしています。
たとえば、2000年に、サウスカロライナ州チャールストンのCell and Tissue SystemsのMike Taylorと彼の同僚は、細胞と臓器の間に位置するウサギの静脈の5cmの長さのセグメントをガラス化しました。複雑であり、加熱後もほとんどの機能を保持することが示されました。
2年後、カリフォルニア州に本拠を置く凍結保存研究会社である21世紀医学のグレッグフェイと彼の同僚は、ガラス転移温度以下に維持してウサギの腎臓をガラス化しました-摂氏122度で10分間、解凍してから48日間生きたウサギに移植してから、調べて屠殺しました。
「その後の生命維持に不可欠な臓器が凍結保存され移植されたのは初めてでした」とFahy氏は言います。 「それが現実的な提案であるという証拠でした。」
しかし、主に特定の部分である髄質が凍結防止剤溶液を吸収するのに時間がかかったため、腎臓は健康なバージョンと同じようには機能しませんでした。
「私たちは元気でしたが、改善しなければならないことも知っていました」とFahy氏は付け加えます。
「これが最も近い」とテイラーは言い、注意書きを付け加えた。 「それは10年以上前であり、この手法が十分に堅牢であれば、その発見を証明する報告書と追跡調査が存在するはずでした。
Fahyは、彼の方法の重要な部分である化学物質の生産を停止したため、一部は進歩が遅いと言います。 しかし、彼のグループは地位を取り戻し、前進しました:2013年のCryobiology Societyの年次総会で、Fahyは、凍結防止剤をコードにもっと速くロードできる方法を発表しました。
Fahyの楽観にもかかわらず、大きな臓器の保存に関しては、ガラス化が手ごわい課題をもたらすことは明らかです。 そもそも、保護するはずの細胞や組織を毒する可能性のある高濃度の凍結防止剤(従来の徐冷よりも少なくとも5倍大きい)が必要です。
化合物をロードするのにより多くの時間が必要であるため、組織が大きいと問題が悪化します。これは、冷却時間が遅くなり、有毒な曝露が発生する機会が増えることを意味します。 また、冷却が速すぎたり、温度が低すぎたりすると、亀裂が生じる場合があります。
この非常にデリケートな加熱プロセスには、より多くの障害があります。 ビトリファイド試験片が急速に加熱されないか、かなり均一に加熱されない場合、ガラス質は結晶化、失透として知られるプロセスに取って代わり、亀裂が発生する可能性があります。
(これは)ミネソタ大学の低温生物学者でありエンジニアのジョン・ビショフ氏によると、まだ克服されていない課題です。制限要因は、解凍できる速度と均一性です。温暖化は通常、外側から内側に向かって行われます。
昨年、Bischofと大学院生のMichael Etheridgeは、この問題を解決する方法を提案しました。それは、凍結防止剤溶液に磁性ナノ粒子を追加することです。
その考えは、粒子が組織全体に分散し、磁場によって励起されると、すべてを迅速かつ均一に加熱することです。 デュオは現在、テイラーと彼の同僚と協力して、ウサギの動脈でこの方法をテストしています。
アクションの氷
ほとんどの場合、この分野の進歩は試行錯誤によってもたらされました。解決策と凍結融解の方法の組み合わせをテストすることです。
しかし、研究者は新しい技術を利用して、細胞や組織内で氷がどのように振る舞うかをより詳しく調べることも始めています。
プロセスが詳細に理解されている場合、それらを制御するための革新的でより効果的な方法を設計できることが期待できます。
過去12か月で、この分野で大きな進歩がありました。 ピッツバーグのカーネギーメロン大学の機械エンジニアであるヨード・ラビンと協力しているテイラーは、大容量の布地で高解像度のフルカラー熱画像を視覚化できる新しいデバイスを導入しました。
一方、ペンシルバニア州のビジャノバ大学のイェンス・カールソンは、最近、氷が2つのしっかりと結合した細胞の間の小さなポケットに入り、その中で結晶化を起こす瞬間から超スローモーション顕微鏡ビデオシーケンスをキャプチャしました。
これらの方法の視点は、凍結プロセスを操作する方法に新しいアイデアをもたらす可能性がある、とカールソン氏は言う。彼は、凍結融解プロセスではなく、凍結融解プロセスを慎重に制御することで組織を凍結保存する方法を見つけようとしているガラス化の。
1つの可能性は、凍結保存に抵抗することができる細胞間接合を形成するように説得できる細胞を遺伝的に設計することです。 次のタスクは、細胞外の氷の形成を指揮し、臓器の機能に影響を与えないようにする方法を見つけることです。
カールソンは、凍結プロセスのコンピューターシミュレーションを使用して、数百万の可能なプロトコルを効果的にテストすることも喜んでいます。
「進歩を加速するためにこの種のツールが必要です」とカールソン氏は語ります。カールソン氏は、タスクを「その努力に捧げる資金のほんの一部で月に到達しようとする」と比較しています。
限られた資源でさえ、この領域は、血管部分などの小さな組織に対して、氷のない凍結保存が実用的であることを示しています。 「残っている重要な障壁は、人間の臓器に合わせて拡張することです」とテイラーは言います。
ガラス化が人間の臓器に役立つ前にそのような努力が「壁にぶつかる」と疑うカールソンにとって、凍結法(または彼が氷ベースの方法と呼ぶもの)は同等またはさらには道を表す成功に向けてより信頼できる。
しかし、真剣に受け止めなければならない最後の概念があります。 「凍結保存技術は、構成細胞の100%の生存を提供しません」とテイラーは言います。
「多くの用途でこれは許容されますが、単一の臓器では、保管または移植後に修復するためにかなりの程度の損傷を意味する可能性があります。」
最終的に、それは、標本がどれほど低温保存されていても、新しく取得された器官と比較して質が劣る可能性が高いことを意味します。
出典:








.jpg)



---zastosowanie-dziaanie-skutki-uboczne.jpg)