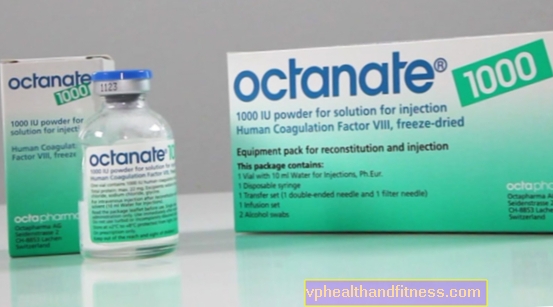
1バイアルには通常250 IU、500 IUが含まれていますまたは1000 IUヒト凝固第VIII因子。この薬にはナトリウムが含まれています(1ミリモル(23 mg)未満/バイアル250 IU、最大1.75ミリモル(40 mg)/バイアル500 IUおよび最大1.75ミリモル(40 mg)/バイアル1000 IU)。
| 名前 | パッケージの内容 | 活性物質 | 価格100% | 最終更新日 |
| オクタン酸塩 | 1バイアル1000 IU +溶解、粉末、溶解して準備する解決ショックのためにおよび/またはINF。 | 第VIII因子 | 2019-04-05 |
アクション
抗出血薬、血液凝固第VIII因子。凝固第VIII因子は、フォンヴィレブランド因子(FVIIIおよびvWF)との二分子複合体として存在し、生理学的機能が異なります。血友病患者に投与すると、第VIII因子は患者の血流中のフォンヴィレブランド因子に結合します。アクティブファクターVIIIは、アクティブファクターIXの補因子として機能し、ファクターXからアクティブファクターXへの変換を加速します。アクティブファクターXは、プロトロンビンをトロンビンに変換します。次にトロンビンはフィブリノーゲンをフィブリンに変換し、これにより血餅が形成されます。製剤を注入した後、第VIII因子の約2/3から3/4が循環に残ります。血漿中で達成される第VIII因子活性レベルは、予測される第VIII因子活性の80%から120%の間でなければなりません。血漿中の第VIII因子活性は、二相性指数分布で減少します。初期段階では、血管内と他のコンパートメント(体液)との間の分布は、3〜6時間の血漿消失半減期を伴います。 。
投与量
静脈内には、2〜3 ml /分を超えて投与しないでください。補充療法の用量と期間は、第VIII因子欠乏症の重症度、出血の部位と程度、および患者の臨床状態によって異なります。投与される第VIII因子の単位数は、WHO承認の第VIII因子製剤の現在の標準である国際単位(IU)で表されます。血漿中の第VIII因子活性は、パーセンテージ(正常なヒト血漿と比較して)またはIUで表されます。血漿中の第VIII因子の国際基準に沿っています。 1 IU第VIII因子活性は、正常なヒト血漿1 ml中の第VIII因子の量と同等です。第VIII因子の必要用量の計算は、1 IUという経験的データに基づいています。第VIII因子/ kg血漿第VIII因子活性を通常の活性の1.5〜2%増加させます。必要な線量は、次の式を使用して決定されます。必要な単位数=月。 (kg)x必要な第VIII因子の上昇(%)(IU / dL)x 0.5。投与量と投与頻度は個別に決定する必要があります。関節、筋肉または口の早期出血:必要な第VIII因子レベルは通常の20〜40%であり、出血によって引き起こされる痛みが治るまで、または創傷が治るまで、注入を12〜24時間ごとに少なくとも1日間繰り返す必要があります。関節、筋肉、血腫へのより広範囲の出血:通常の30〜60%、12〜24時間ごとに3〜4日以上、注入を繰り返し、痛みの緩和と機能が回復するまで繰り返します。生命にかかわる出血:脅威が解決するまで、通常の60〜100%、8〜24時間ごとに注入を繰り返します。抜歯を含む小規模な手術:創傷が治癒するまで、24時間ごとに少なくとも1日、標準の30〜60%。大手術:正常の80-100%(手術前後)、創傷が適切に治癒するまで8〜24時間ごとに注入を繰り返し、その後少なくとも7日間治療を継続して第VIII因子活性を30に維持します-60%。持続注入:手術前に推定クリアランスを計算する必要があります。初期注入速度は、次のように計算できます。クリアランスx所望の定常状態濃度=注入速度(IU / kg / h)。連続注入の最初の24時間後、クリアランスは、測定された濃度と既知の注入速度で固体状態の式を使用して毎日再計算する必要があります。用量を計算し、注入の頻度を決定するには、血漿第VIII因子レベルの定期的な決定が必要です。重度の血友病A患者の出血を長期的に予防するには、20〜40 IUの第VIII因子用量を投与する必要があります。第VIII因子/ kg 2〜3日の間隔で。
適応症
血友病A(先天性第VIII因子欠乏症)患者の出血の治療と予防この薬は薬理学的に有効な量のフォンヴィレブランド因子を含まないため、フォンヴィレブランド病の治療には使用できません。
禁忌
活性物質または成分のいずれかに対する過敏症。
予防
過敏症の症状が発生した場合は、直ちに製剤の使用を中止してください。人間の血液または血漿の準備による感染を防ぐ標準的な方法には、ドナーの選択、個々の寄付と血漿のプールの特定の感染マーカーのテスト、効果的な製造方法を使用したウイルスの不活化/除去などがあります。それにもかかわらず、ヒトの血液または血漿から調製された医薬品が投与された場合、感染因子を感染させる可能性を完全に排除することはできません。これは、未知のウイルスや新興ウイルスやその他の病原体にも当てはまります。使用される方法は、HIV、HBV、およびHCVなどのエンベロープウイルスに対して効果的であると見なされ、HAVやパルボウイルスB19などのエンベロープを持たないウイルスに対しては限られた価値しかありません(妊娠中の女性や、免疫不全または過剰な赤血球形成のある患者にとって危険な場合があります)。 (A型肝炎およびB型肝炎に対する)適切なワクチン接種は、ヒト凝固第VIII因子による定期的または反復的な治療を受けている患者に示されます。血友病Aの患者を治療する場合、第VIII因子中和抗体(阻害剤)の発生は既知の合併症です。適切な臨床観察と検査室検査により、阻害抗体の発生について患者を監視する必要があります。文献には、第VIII因子インヒビターの発生とアレルギー反応との相関を示す報告があります。アレルギー反応を経験した患者は、第VIII因子によって誘発されるアナフィラキシーのリスクが高いため、阻害剤について検査する必要があります。アレルギー反応のリスクがあるため、第VIII因子の最初の投与は、アレルギー反応が発生した場合に適切な医療支援を提供できる場所で、医師の裁量のもと、医療監督の下で実施する必要があります。薬はナトリウムを含みます-250 IUの1バイアル1ミリモル(23 mg)未満のナトリウムが含まれています。つまり、この用量は基本的に「ナトリウムフリー」であり、500 IUのバイアル1本です。または1000 IU最大1.75ミリモル(40 mg)のナトリウムが含まれていますが、ナトリウム制限食を摂取している患者ではこの点を考慮する必要があります。
望ましくない活動
まれ:過敏反応、発熱、血中に存在する抗第VIII因子抗体。非常にまれ:アナフィラキシーショック。
妊娠と授乳
女性ではまれに血友病Aが発生するため、妊娠中および授乳中の第VIII因子の使用に関する経験はありません。したがって、妊娠中および授乳中の第VIII因子は、厳密に指示された場合にのみ投与する必要があります。
相互作用
ヒト凝固第VIII因子製剤と他の薬物との相互作用は知られていない。
準備には物質が含まれています:第VIII因子
償還された薬物:いいえ