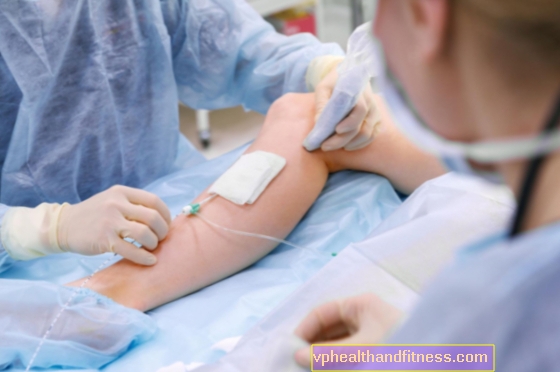
単回投与のプレフィルドシリンジには、0.3 mgの遊離酸オリゴヌクレオチドに対応する1.65 mgのペガプタニブナトリウムが、90 µlの公称容量で含まれています。
| 名前 | パッケージの内容 | 活性物質 | 価格100% | 最終更新日 |
| マクゲン | 1個、ソリューションショックのために | ペガプタニブナトリウム | 2019-04-05 |
アクション
ペガプタニブは、細胞外型の内皮細胞増殖因子(VEGF165)に選択的かつ強力に結合し、その活性を阻害する修飾ペグ化オリゴヌクレオチドです。 VEGFは、血管新生を誘導し、血管透過性を高め、炎症誘発性である分泌タンパク質です。これらの行動はすべて、血管新生を伴うAMDの進行を説明しているようです。 VEGF165は、眼球内の病的な血管新生に優先的に関与するVEGFアイソフォームです。ペガプタニブで治療されたAMD患者では、平均病変サイズ、脈絡膜血管新生(CNV)サイズ、およびフルオレセイン漏出サイズの減少が観察されました。動物では、ペガプタニブは硝子体内投与後、目から全身循環にゆっくりと吸収されます。片眼に3 mgの用量(推奨用量の10倍)を投与した後の血漿中ペガプタニブの見かけの平均±半減期は10±4日です。平均ピーク血漿濃度は、片方の目に3 mgを投与してから1〜4日後に到達します。ペガプタニブは硝子体内投与後6週間ごとに血漿中に蓄積せず、エンドヌクレアーゼおよびエキソヌクレアーゼによって代謝されます。それは親の形で排泄され、代謝物は主に尿中に排泄されます。
投与量
硝子体内注射の投与経験のある眼科医が使用する必要があります。製剤は、罹患した眼の硝子体に6週間に1回(年間9回の注射)投与する必要があります。投与前に、溶液が濁ったり変色していないことを確認してください。注射は、外科的洗浄と手、無菌手袋、無菌ドレープ、および眼鏡の消毒を使用し、無菌状態で実施する必要があります。また、必要に応じて、無菌状態で穿刺を行う可能性もあります。患者の病歴は、注射前に過敏反応の存在について注意深く再評価されるべきです。注射の前に、適切な麻酔と局所広域抗生物質を投与する必要があります。製剤の投与後、眼圧の一時的な増加が観察されたため、視神経の灌流と眼圧を監視する必要があります。さらに、注射後2週間は、硝子体出血と眼内炎について患者を注意深く監視する必要があります。 2回の連続注射の後、12週間の治療の訪問時に患者に治療上の利点が見られない場合(視力テストで15文字未満が失われる)、治療の中止または中断を検討する必要があります。プレフィルドシリンジには、過剰なプレパレーションが含まれています。過度の量の薬物を投与してはならない。過剰分は、投与手順の準備中に廃棄する必要があります。肝不全、または中等度または軽度の腎不全を伴う高齢患者における薬物の使用に関する特別な推奨事項はありません。
適応症
成人患者における加齢性黄斑変性症(AMD)の新生血管(ウェット)フォーム。
禁忌
ペガプタニブまたはいずれかの賦形剤に対する過敏症。眼球またはその周辺の感染が疑われる、または活動的。
予防
他の硝子体内製剤と同様に、眼圧の一時的な増加が発生する可能性があります。このため、視神経への血液供給を確認し、注射後の眼圧の上昇を適切な治療で修正する必要があります。ペガプタニブ注射の直後(注射当日)または遅延した硝子体内出血が発生することがあります。硝子体内注射の手順には眼内炎のリスクがあります。 18歳未満の患者における製剤の安全性と有効性のプロファイルは確立されておらず、肝不全または重度の腎不全の患者における製剤の使用は研究されていません。プレフィルドシリンジの全容量を注入すると、深刻な副作用が発生する可能性があるため、注入前に過剰分を除去する必要があります。
望ましくない活動
非常に一般的:前房炎症、眼痛、眼圧上昇、点状角膜炎、沈殿物、硝子体の曇り。一般的:頭痛、眼の不快感、白内障、結膜出血、結膜充血、結膜浮腫、結膜炎、角膜ジストロフィー、角膜上皮欠損、角膜上皮障害、角膜浮腫、ドライアイ、内眼炎、眼分泌物、目の炎症、目の炎症、目のかゆみ、目の発赤、目の腫れ、まぶたの浮腫、涙の増加、黄斑変性症、瞳孔拡張、目の不快感、高眼圧症、眼周囲血腫、羞明、瞬き、網膜出血、かすみ目、視力障害、視力障害、硝子体剥離、硝子体障害、鼻水。珍しい:悪夢、うつ病、眼精疲労、眼瞼炎、アレルギー性結膜炎、角膜沈着物、眼出血、眼瞼掻痒、角膜炎、硝子体出血、瞳孔反射障害、角膜剥離、網膜滲出液、眼瞼下垂、瘢痕網膜、ハラジオン、角膜潰瘍、眼圧の低下、注射部位反応、注射部位の水ぶくれ、網膜剥離、角膜障害、網膜動脈閉鎖、網膜裂傷、外斜視、眼球運動障害、まぶたの刺激、前房出血、瞳孔障害、虹彩障害、目の黄変、ブドウ膜炎、目の奥の沈着、虹彩炎、視神経のくぼみ、瞳孔の変形、網膜静脈閉塞症および硝子体脱出、難聴、メニエール病の悪化、めまい、動悸心臓病、高血圧、大動脈瘤、炎症喉の痛み、嘔吐、消化不良、接触皮膚炎、湿疹、髪の色の変化、発疹、かゆみ、寝汗、背中の痛み、疲労、悪寒、圧痛、胸痛、インフルエンザのような症状、GGTレベルの上昇、摩耗。不明:アナフィラキシー反応(血管浮腫を含む)。市販後の経験では、血管浮腫を含むアナフィラキシー/アナフィラキシー様反応のまれな症例が、注射の準備手順中にペガプタニブおよび他の医薬品を投与してから数時間以内に患者で報告されています。注入前にプレフィルドシリンジから過剰な量の製品を除去できなかったため、前眼房の穿刺を必要とする眼圧の深刻な上昇の事例が報告されています。眼内圧の持続的なわずかな増加は、市販後調査研究で複数回の硝子体内投与後にも観察されました。眼圧上昇の可能性は、その後の硝子体内注射ごとに1.128倍に増加しました(p = 0.0003)。眼圧上昇または緑内障の既往歴のある患者と陰性歴のない患者との間で、眼圧上昇の発生率に統計的に有意な差はありませんでした。
妊娠と授乳
ペガプタニブは妊婦で研究されていません。動物実験は不十分ですが、高用量および全身暴露で生殖機能に毒性影響を示しています。眼内投与後の全身曝露は非常に低いと思われます。母親への潜在的な利益が胎児への潜在的なリスクを取ることを正当化する場合にのみ、妊娠中に準備を使用する必要があります。準備がミルクに排泄されるかどうかは不明です-授乳中に準備を使用することはお勧めできません。
コメント
患者は硝子体内投与後、視力が一時的に低下することがあります。これらの症状が解決するまで、機械を運転したり使用したりしないでください。冷蔵庫(2〜8℃)に保管してください。凍結しないでください。
相互作用
薬物相互作用の研究は行われていません。ペガプタニブはヌクレアーゼによって代謝されるため、シトクロムP450を介した相互作用は予期されません。準備のみまたは準備と光線力学療法を受けた患者で行われた2つの初期段階の研究では、ペガプタニブの血漿中薬物動態に明らかな違いは示されませんでした。
準備には物質が含まれています:ペガプタニブナトリウム
償還された薬物:いいえ